GMAのこれまでとこれから:GMAのクリニカルパール探求

アダカラムインタビュー記事シリーズ
GMA 20年をこえる臨床知見からの提言
全国の先生方より、消化器および皮膚領域における最新の診療状況を踏まえた上で、様々な視点から顆粒球吸着療法(GMA)の日常診療における活用方法や工夫、メリットや課題についてお話いただきます。
IBD:炎症性腸疾患、UC:潰瘍性大腸炎、CD:クローン病、PP:膿疱性乾癬、PsA:乾癬性関節炎(関節症性乾癬)
※先生のご所属先および役職、治療指針等は掲載時点の情報です
弘前大学消化器血液内科学講座の特徴とIBD診療の実際
当講座は、1960年代から大腸内視鏡および周辺機器を含めた開発に挑み、現在の診断法確立の礎を築くなど、数多くの実績を有する伝統的な講座として、現在も先駆的な研究に取り組んでいます。臨床では、消化器疾患と血液疾患及び、炎症性腸疾患(IBD)や全身性エリテマトーデス(SLE)、関節リウマチ(RA)を含む自己免疫疾患など、幅広い分野の疾患の診療を一つの講座が担う全国的にも数少ない講座となっています。この点は、例えば重症感染症の有害事象が発生した際に、血液領域の知見を活用できるなど、幅広い豊富な経験に基づいた的確な診療に寄与するものと考えています。
教育および研修面では、若手医師の臨床修練に重点をおいており、研修体制の整備や研究などを支援しています。また、COVID-19の流行以降、学会や研究会はオンライン開催が主流となったことから、若手医師に直接アプローチする機会が減少しています。そこで若手医師のリクルートも兼ねて、青森県内の主要な研修病院にて『当直で使える腹部エコーのコツ&胃カメラハンズオン&マルク体験』と称したセミナーを開催し、消化器血液内科の魅力を発信しています。
IBD診療に関しては、グループ診療を重視しており、多職種がそれぞれIBDに対する知識と経験を蓄え、患者さんに寄り添いながら検査や治療に臨んでいます。一例として、クローン病(CD)におけるカプセル内視鏡検査では、センサーアレイ等の身体への装着はジェンダーを考慮して行う、その他の検査や治療においても看護師や臨床工学技士がIBDの症状を理解した上で、注意深く観察しながら実施しています。顆粒球吸着療法(GMA)の施行も同様に、血液浄化療法室などのスタッフが、IBDの病態を把握して患者さんの状態を観察し、適切な声掛けなどを行うことで、不安の解消が図られています。
IBD病態解明と新規治療に関するトピックス
当講座ではこれまでに、非侵襲的なMRI検査に着目して、IBDの疾患活動性評価に関する研究を行っており、例えばCDの寛解導入1年後の拡散強調画像(DWI)が、そこから2年後における寛解維持の予測因子となり得る点などを報告してきました1)。近年は、CDの小腸切除標本の組織学的所見とMR-DWI所見とを比較し、MR-DWIが組織学的な炎症細胞浸潤を反映していることを明らかにし、腸管における簡便な消化管全層の炎症評価法としての可能性が示唆されました2)。なお、この小腸切除標本を用いた検討から、炎症細胞浸潤の少ない部位においても発現を認める接着分子のMAdCAM-1がCDの新規治療、あるいは寛解維持療法におけるターゲットの一つとして期待されると考えています。
新規治療に関しては、有害事象など様々な議論も存在する青黛(せいたい)を含有する漢方薬の潰瘍性大腸炎(UC)に対する効果が報告されていますが3)、その機序の一つと考えられる芳香族炭化水素受容体(AhR)を介した作用は、同時に肺動脈性肺高血圧症(PAH)のリスクとなる点が指摘されています4)。一方、当講座では、食べることも可能な染料である"あおもり藍"に注目して、生体への様々な効果を検証していたところ、UCモデルマウスにおいて体重減少および大腸の組織学的炎症の改善を認めました5)。ここで注目すべきは、あおもり藍の抗炎症効果がAhRを介しておらず、抑制性サイトカインのIL-10活性化を経路としていた点であり、この機序の解明により、今後の新たな治療の可能性が示されたものと期待しています。
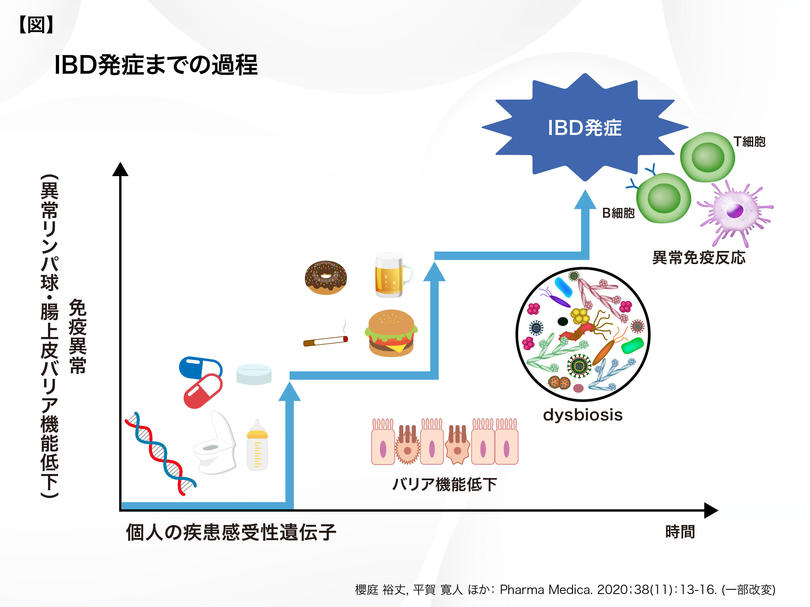
IBDは、患者個々の病態が多様であるだけに、様々なアプローチによる治療が望まれますが、この多様な病態形成には、患者さんの遺伝的要因と環境要因に加え、この両者を結ぶ因子として腸内細菌叢も重要となります【図】。例えば、環境要因として摂取された食物繊維は、Clostridium 属を主とした腸内細菌により、酪酸などの短鎖脂肪酸へと代謝されます。この酪酸は、腸管上皮細胞のTGF-β1活性化を介して、制御性T細胞を誘導し、腸管粘膜の炎症をコントロールすることが報告されており6)、腸内細菌や食事に着目したIBD治療も期待されます。なお、GMAの施行後はBifidobacterium 属が増加するなど7)、各種IBD治療後に生じる腸内細菌叢の変化は、再燃抑制に寄与する可能性も考えられるため、更なる知見の集積が待たれます。
寛解維持に関与する因子として、私たちは腸管粘膜のバリア機能に注目し、腸管上皮機能の維持による再燃抑制について研究を進めています。その一つとして、カルシニューリン阻害薬は、活性化T細胞機能抑制効果により抗炎症作用を発現しますが、さらに腸管上皮細胞のアポトーシスを介した粘膜障害抑制作用を認め8,9)、すなわちバリア機能改善と粘膜修復効果の可能性が示唆されました。加えて、その効果は、腸管上皮細胞の酪酸輸送蛋白であるMCT-1の発現調節効果も持つことが明らかとなりました10)。腸管上皮細胞に対する様々な効果が、臨床における高い治療効果につながっていると考えられます。
このような腸管のバリア機能は、酪酸等を産生する腸内細菌叢の関与が大きいため、便移植(FMT)による臨床研究も行われていますが、米国より死亡例を含む菌血症の発現が報告されるなど11)、安全性の検証が求められる状況となっています。IBDの寛解維持において、特に食事制限が殆ど無いUCの場合、腸内細菌叢への介入は食事を中心とすることが理想的であり、薬物療法を伴わず食事介入のみで再燃抑制が実現できれば、副作用や薬物相互作用などの面から、安全性に考慮した寛解維持療法になると考えています。腸内細菌叢へ影響を与える食事として、果物や野菜、発酵食品などが考えられますが、例えばリンゴなどは季節により継続的な摂取が難しいため、エビデンスの構築は困難であることが予想されます。しかし、食事と腸内細菌叢の変化について、大規模な疫学データが収集されれば、IBDのみならず大腸癌などにも幅広く応用できるため、行政の協力も得た形での研究体制整備に貢献できればと考えております。
弘前大学におけるIBD治療戦略とGMAへの期待
当院においては、免疫学的便潜血検査(FIT)による便中ヘモグロビンおよび便中カルプロテクチン(FC)の検査値が同じ検体から同時に約15分で得られます。このため、来院時に検体を提出してもらい測定、その結果を見ながら問診を行い、診療方針を決定していくことが可能です。例えば、自覚症状に乏しい中、これらバイオマーカーが上昇した場合、次回の来院間隔を1カ月前後に短縮する、あるいは直腸炎型か左側大腸炎型で局所製剤未投与であれば、局所製剤を追加します。特に、FITとFCの双方が同時に上昇した際は、5-アミノサリチル酸(5-ASA)製剤の増量や局所製剤の追加が、その後の再燃予防に有効であると考えます。
一方、FCが高値にも関わらず自覚症状を訴えない患者さんでも、より具体的な問診を行うことで、多くの場合は再燃の兆候を自覚していることがわかります。必要に応じて内視鏡検査も行いますが、バイオマーカーは再燃抑制に向けた早期の治療介入を可能とした点で、その意義は大きいと捉えています。
当院では、入院を要するIBDの寛解導入療法において、治療強化を目的にGMAを併用する場合が多くなっています。非薬物療法であるGMAは、安全性や薬物相互作用などの面から薬物療法への上乗せも行いやすく、独自の作用機序から他の治療薬の作用を阻害する可能性も少ないと考えます。
GMAによるUC維持療法に関しては、担癌患者やinfusion reactionなど分子標的薬による維持療法が困難な場合の重要な選択肢の一つと考えます。ただし、特に都市部よりも地方においては、対応できる施設が少ないことや交通機関が不便であることから、月2回の通院は負担も大きいため、月1回のGMAによる維持療法の成績についてエビデンスの構築が期待されます。また、粘膜治癒に治療目標を置き、例えば臨床的寛解導入後も一定期間月2回のGMAを行いながらステロイドフリーと粘膜治癒を導き、その後月1回の寛解維持療法に移行する治療方針も考えられます。いわば、造血器腫瘍に対する化学療法において、寛解導入療法と寛解維持療法の間に実施する"地固め療法"的なアプローチです。このような検討が行われることで、過度な免疫抑制を伴わない寛解維持療法が確立されていくことを期待します。
1) Sakuraba, H., Ishiguro, Y. et al.:Digestion. 2014;89(1)::49-54.
2) 蓮井 桂介, 櫻庭 裕丈 ほか:日本消化器病学会雑誌. 2022;119(suppl-1):A110. (第108回日本消化器病学会総会, 2022年4月)
3) Naganuma, M., Sugimoto, S. et al.:Gastroenterology. 2018;154(4):935-947.
4) Masaki, T., Okazawa, M. et al.:Proc Natl Acad Sci USA. 2021;118(11):e2023899118.
5) Asari, T., Kikuchi, H. et al.:Biochem Biophys Rep. 2022;30:101272.
6) Atarashi, K., Tanoue, T. et al.:Nature. 2013;500(7461):232-236.
7) 柏木 里織, 髙木 智久 ほか:日本消化器病学会雑誌. 2017;114(suppl-2):803. (第59回日本消化器病学会大会, 2017年10月)
8) Sakuraba, H., Ishiguro, Y. et al.:Biochem Biophys Res Commun. 2007;359(3):406-412.
9) Satoh, Y., Ishiguro, Y. et al:Am J Physiol Gastrointest Liver Physiol. 2009;297(3):G514-G519.
10) Ota, S., Sakuraba, H. et al.:Biochem Biophys Rep. 2020;24:100811.
11) DeFilipp, Z., Bloom, P.P. et al.:N Engl J Med. 2019;381(21):2043-2050.