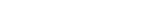GMAのこれまでとこれから:GMAのクリニカルパール探求
アダカラムインタビュー記事シリーズ
GMA 20年をこえる臨床知見からの提言
全国の先生方より、消化器および皮膚領域における最新の診療状況を踏まえた上で、様々な視点から顆粒球吸着療法(GMA)の日常診療における活用方法や工夫、メリットや課題についてお話いただきます。
IBD:炎症性腸疾患、UC:潰瘍性大腸炎、CD:クローン病、PP:膿疱性乾癬、PsA:乾癬性関節炎(関節症性乾癬)
※先生のご所属先および役職、治療指針等は掲載時点の情報です
腸内細菌叢や糞便細菌叢移植の研究から臨床上の課題に挑む滋賀医科大学
当科は、2005年に近畿地方におけるIBD診療の中心的施設としてIBDセンターを開設し、地域医療を支えながら、併せて新規治療法の開発、病因・病態解明、治験や医師主導臨床試験を積極的に推進してきました。それらの知見も活用しながら、私たちは厚生労働省の難治性炎症性腸管障害に関する研究班への協力や、各種レジストリ研究および診療ガイドラインの策定も支援しています。
一方、当科における重要な研究テーマとして"腸内細菌叢"の解析および"糞便細菌叢移植(FMT)"があげられ、様々な疾患を対象に検討を重ねています。その一つとして、再発を繰り返すことで臨床上の大きな課題となる「再発性Clostridioides difficile (C. difficile )感染症」に対して、FMTの治療効果を検討してきました。既報どおりに、再発性のC. difficile 感染症に対するFMT治療効果は高いことが判明し、さらに高齢者の再発性C. difficile 感染症においても、FMTが有害事象を認めず有効性を示すことを報告しています1) 。欧米では、C. difficile の中でも重症化率や抗菌薬耐性化率の高いバイナリートキシン産生株が増加しており2) 、日本へ伝播した際の影響が危惧されています。従って、事前に日本人の腸内細菌叢に適したFMTの手法を探索することで、バイナリートキシン産生株に備えると共に、現在、社会問題化している薬剤耐性(AMR)対策にも寄与するものと考えています。
ヒトと腸内細菌叢との協調的な共生関係 " Symbiosis "が乱れると 各種疾患への影響 も
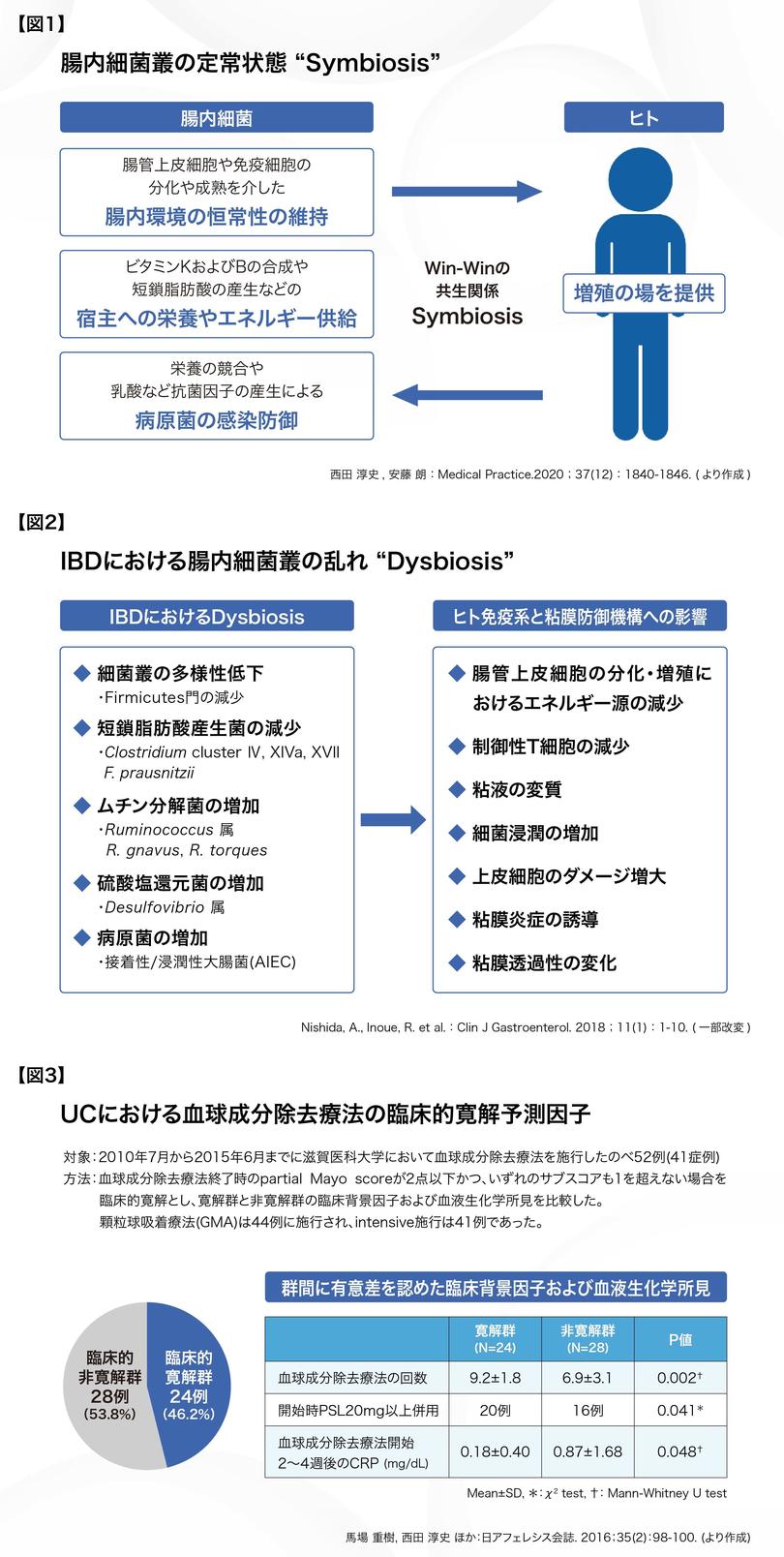
これまでの研究によって、腸内細菌叢は生体の恒常性維持に重要な役割を果たしていることが分かっており、腸内細菌叢は一つの臓器とも捉えられています。そして、ヒトと腸内細菌叢とが複雑に相互作用することで、協調的な「腸内生態系(腸内エコシステム)」を形成していると考えられます。すなわち、ヒトが腸内細菌叢に増殖の場を提供する対価として、腸内細菌叢は腸内環境の維持や栄養供給、感染防御などの役割を担っているのです【図 1 】。このWin-Winの定常状態にある共生関係を"Symbiosis"と呼びます。その反面、腸内細菌叢が乱れた場合は、宿主の健康に様々な影響が及んでしまいます。この腸内細菌叢の乱れた状態を"Dysbiosis"と呼び、IBDはもとより内分泌疾患や神経変性疾患など様々な疾患への関与が疑われています。
IBDにおけるDysbiosisでは、Firmicutes門の減少など多様性が低下してしまい、酪酸など短鎖脂肪酸産生菌が減少する一方で、ムチン分解菌や炎症惹起性大腸菌が増加します【図 2 】。これらにより、腸管上皮細胞の分化増殖の抑制や粘液の変質、バリア機能低下、制御性T細胞(Treg)の減少などが引き起こされると考えられています。例えば、酪酸産生菌として重要なFirmicutes門Clostridium cluster IVのFaecalibacterium F. prausnitzii は、クローン病(CD)における減少が報告されていますが3) 、酪酸はTGF-β1活性化などを介してTregの分化・増殖を促進しているため、F. prausnitzii の減少がTregの減少にもつながり、炎症性の病態形成へ関与するものと推察されます。
集学的治療の一つとして IBD の腸内細菌叢へ介入する FMT への期待
一方、IBDの腸内細菌叢は、各種治療により変化することが興味深い点であり、顆粒球吸着療法(GMA)も例外ではありません。例えば、GMA治療後のUC患者においてビフィズス菌が含まれるBifidobacteriales目の増加が報告されています4) 。食物繊維はビフィズス菌などにより乳酸と酢酸に代謝され、それをClostridium cluster IVが酪酸へと代謝するため、今後、酪酸や腸内細菌叢に着目したGMA治療に関する知見の集積が期待されます。
このようなIBD治療による二次的な変化のみならず、腸内細菌叢へ直接介入する手法として、抗菌薬の前投与を含むFMTが世界各国で研究されており、UCにおけるメタアナリシスでは、臨床的寛解が36%と報告されています5) 。これらの検討では、抗菌薬の前投与が一つのポイントであり、私たちが行った抗菌薬非投与下のUC 41例に対する検討では、臨床的寛解が0%、臨床的改善が26.8%に留まり6) 、他の同様の報告でも臨床的改善は10.0%(1/10)でした7) 。一方、抗菌薬の前投与を行った日本のUC 17例では、臨床的寛解が35.3%、臨床的改善が82.4%と良好な反応性が得られています8) 。
このように、FMT単独では日本のUC患者における寛解導入療法には限界を認めますが、いずれの検討においても安全性は優れていた点から、治療が長期化する寛解維持療法における可能性が期待されます。実際に2019年の報告では、FMTによるUC寛解維持療法によって、内視鏡的寛解率はプラセボ群に比べ有意に上昇していました9) 。
近年のUC治療では、集学的治療の重要性がより一層高まっていますが、栄養療法やFMTと同じ非薬物療法の血球成分除去療法(CAP)によるUCの寛解維持療法における効果が、CAPTAIN study10,11) において検討されています。その結果、52週後の粘膜治癒率が対照群に比べ有意に上昇しており、さらに最終評価時までに全例がステロイド離脱に至りました。寛解維持療法は長期に及ぶだけに、安全性を考慮しながら十分な寛解維持効果を必要とする際に、FMTやGMAなどの併用による治療効果は、今後検討する余地があろうかと考えます。
UC 治療の選択肢多様化にも関わらず、未だ残されている課題の解決に向けて
近年のUC治療は、分子標的薬の登場により難治例や重症例の治療成績が大きく向上しました。その一方で、残された課題として、軽症から中等症に対する安全性に優れた治療選択肢は決して十分とは言えないのではないでしょうか。すなわち、ステロイド全身投与までは必要としない重症度における治療強化のあり方や、分子標的薬投与までは必要としないステロイド投与歴が浅いUC患者に対して、ステロイド依存性や抵抗性を生じさせることなく寛解導入を図る治療戦略などです。これら、いわば治療の空白部分を埋めるような位置付けの選択肢について、私たちIBD専門医が非薬物療法を含む幅広い知見を集積し、エビデンスを構築しながら今後の治療指針を策定する必要があると考えています。
また、増加を続ける高齢UC患者への対応も、重要な課題の一つです。そこで、当院において入院加療を行った高齢UC患者の臨床的特徴や治療状況を調査しました12) 。まず、入院時の重症度や血液検査所見、入院までの治療内容について、非高齢者との間に有意差は生じず、さらに入院後においても、治療内容や治療関連有害事象、手術率などに有意差を認めませんでした。ただし、高齢入院患者の数少ない特徴として、併存疾患としての高血圧、糖尿病、悪性腫瘍の有病率が非高齢者に比べ有意に上昇していた点には注意が必要です。これら高齢入院患者における併存疾患や易感染性が考慮されたためか、当院ではGMAを含むCAPの施行率が、高齢UC患者 40.9%(9/22) 、非高齢UC患者 23.6%(26/110) となっていた点はリアルワールドデータにおける興味深い結果ではないでしょうか。
このように、入院を要する高齢UC患者の寛解導入療法では、併存疾患に注意する必要があるものの、GMAの併用なども行いながら非高齢者と同様に治療強化を図り、速やかに寛解へ導くことが求められます。この速やかな寛解導入に向けて、各種治療の継続や変更を判断するための効果予測因子の探索も重要です。例えば、CAPによる寛解導入療法において、私たちの検討では寛解群におけるCAP施行2~4週後のC反応性蛋白(CRP)が非寛解群と比べ有意に低いことが認められました【図 3 】。CRPは測定しやすい生化学マーカーであるため、CAPの臨床的寛解予測因子としての活用が期待されます。さらに、新たなsurrogate markerとして、便中カルプロテクチンやロイシンリッチα 2グリコプロテイン(LRG)などが測定可能となっているため、それらのマーカーとGMAの効果との関連性についても検討が望まれます。
一方、長期に及ぶ高齢UC患者の寛解維持療法では、生理機能低下や易感染性などに注意しながら、安全性を重視した治療が求められます。GMAは、全国93施設による多施設コホート研究"PARTICULAR study13) "において、高齢者や妊婦など特別な背景を有するUC患者に対する寛解導入療法の効果と安全性が検証されています。従って、高齢UC患者の寛解維持療法においても、治療選択肢の一つとなり得るのではないでしょうか。この他にも、FMTをはじめ、正常な腸内細菌叢(Symbiosis)を目指した栄養療法など、非薬物療法による介入には大きな可能性が残されています。今後これら非薬物療法を含めた、UCの集学的治療による長期安全性に優れた寛解維持療法の確立に期待しています。