GMAのこれまでとこれから:GMAのクリニカルパール探求
アダカラムインタビュー記事シリーズ
GMA 20年をこえる臨床知見からの提言
全国の先生方より、消化器および皮膚領域における最新の診療状況を踏まえた上で、様々な視点から顆粒球吸着療法(GMA)の日常診療における活用方法や工夫、メリットや課題についてお話いただきます。
IBD:炎症性腸疾患、UC:潰瘍性大腸炎、CD:クローン病、PP:膿疱性乾癬、PsA:乾癬性関節炎(関節症性乾癬)
※先生のご所属先および役職、治療指針等は掲載時点の情報です
四日市羽津医療センターにおける IBD 診療の実際
当院は三重県で唯一、炎症性腸疾患(IBD)専門センターを有し、2023年における累積患者数が潰瘍性大腸炎(UC) 約1,560例、クローン病(CD)約600例と、県内外のIBD患者さんを支えるハイボリューム施設です。情報発信を重要視しており、IBD患者会への参加や、当院のWebサイトを通じて疾患に関する最新の知見や治療法を紹介するなど、積極的に活動しています。Webサイトは、患者さんのみならず研修医や連携施設においても活用いただけることを期待しています。
当院は地域の炎症性腸疾患センターとしてIBDの重症例や合併症を有する患者さんなどの紹介を受けていますが、この際、手術のタイミングを逃さないことにも重きをおきながら診療に臨んでいます。手術介入が予測される場合、なるべく早めに患者さんへ手術の可能性について伝え、薬物療法を進めながら少しずつ手術を受け入れて貰えるよう説明を行っています。併せて、内科と外科の連携を強化しながら、私たち外科医も内科的治療を学び、最先端の治療を患者さんに届けることを目標として、日常診療に注力しています。また四日市地域における啓発活動として、著名な講師の招聘や当院の症例紹介などを中心とした勉強会を開催しており、IBD診療に対する地域全体の意識向上を目指しています。さらに当院では、数多くの治験や臨床試験への参加をはじめとして、新たな臨床研究も積極的に推進しています。
IBD 診療における便中カルプロテクチンの活用法
便中カルプロテクチン(fCAL)は、好中球から分泌されるタンパク質であり、腸管の炎症度を反映するバイオマーカーです。便中で安定性を保つ特徴があるため、便の採取後5日以内であれば検体の信頼性も維持され、また比較的安価であることから、当院をはじめ多くの施設において活用されています。fCALの精度については、内視鏡所見との強い相関が既存のメタ解析において報告されており、我々のデータでは感度89%、特異度87%にて内視鏡的炎症の検出能が示されています1) 。
臨床におけるfCALの重要な役割として、IBDの再燃予測が挙げられます。私たちはUCやCDの再燃予測におけるfCALの有用性2,3) や、UCの5-アミノサリチル酸(5-ASA)局所製剤による寛解維持療法中に再燃した場合、その8週前にfCALが先行して上昇すること4) などを報告してきました。このような結果は、fCALが再燃の兆候を鋭敏に捉えるバイオマーカーとして有用である可能性を示唆しているものと考えています。
fCALにより再燃の兆候を捉えた場合、5-ASA製剤の増量などの対応を検討すべきですが、併せて服薬アドヒアランスの確認が重要です。この際、単に服薬状況を尋ねるのではなく、『便中マーカーの数値が上がっていますが、最近きちんと薬を飲めていますか?』あるいは『局所製剤を毎日使用していますか?』と、fCALを理由にして質問すると、『忘れ気味です』といった率直な回答を得られやすい印象があります。このように、fCALをいわばコミュニケーションツールとして活用することで、患者さんがfCALと服薬アドヒアランスの相関について理解を得やすくなります。そして、客観的な数値で示されるfCALの維持がモチベーションとなり、服薬意識の向上や前向きな内視鏡検査の受容にもつながると考えます。
IBD 治療における GMA の意義と可能性
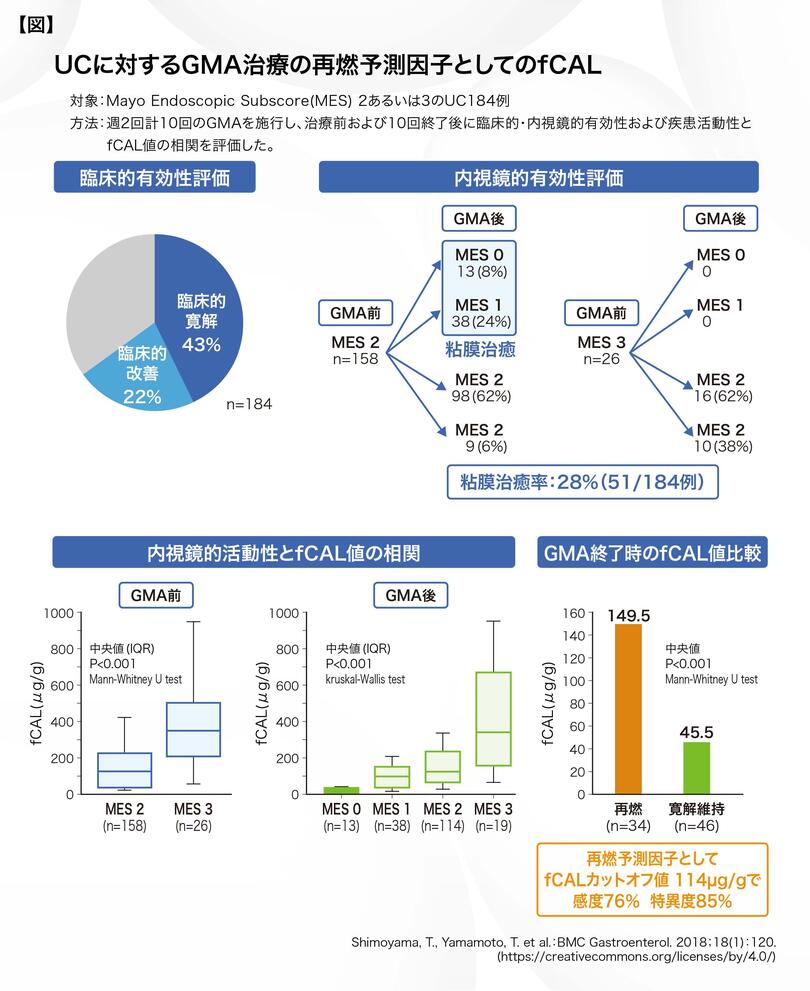
前述のfCALは、顆粒球吸着療法(GMA)による寛解導入後の再燃予測因子としても活用が期待されます【図 】。当院の検討では、UC 184例を対象として、週2回のGMAを計10回施行したところ、臨床的寛解率は43%、粘膜治癒率は28%を示しました。また、GMAの治療前後において、Mayo Endoscopic Subscore (MES)とfCAL中央値は有意な正の相関を示しました。そして、GMAにより寛解導入に至ったUC患者さんにおいて、治療後1年間の経過観察中に再燃を認めた群では、寛解維持群に比べ、GMA終了時のfCAL中央値が有意に高値でした。この治療終了時のfCALカットオフ値を114μg/gとすると、感度76%、特異度85%にて、治療後1年以内の再発の予測因子となることが示唆されました5) 。
また、UCに対するGMAの寛解導入療法に関して、効果が期待できる患者像を検討するために、当院と浜松南病院、浜松医科大学が共同研究を行いました6) 。その結果、GMAの有効性予測因子として、〔年齢60歳以下〕〔罹病期間1年未満〕〔MES 2(MES 3との比較)〕〔ステロイドナイーブ〕〔生物学的製剤(Bio)ナイーブ〕の5項目が抽出されました。そして臨床的寛解率は、より多くの予測因子を有するUC患者さんにおいて有意な上昇が認められました。注目すべき点として、Bioナイーブが有効性予測因子となっている点から、Bioの投与前にGMA導入を選択肢の一つとして検討することが、将来の治療選択肢の温存に寄与するものと考えます。
2021年までのGMAは、UCの維持療法に対する保険適用が認められていなかったため、寛解導入療法において選択し難い側面もありました。しかし、2022年より寛解維持療法に対しても保険適用されたことで、GMAは活用の幅が広がったと私は考えています。GMAで寛解導入に至った場合は、GMAの維持療法においても良好な反応が期待されることから7) 、考慮すべき選択肢の一つとして期待できるのではないでしょうか。
UC の寛解維持療法における GMA の意義
私たちは、UCの寛解維持療法におけるGMAの治療成績について、27例を対象とした前向き臨床試験を行い、2023年12月の第14回日本炎症性腸疾患学会学術大会において報告しましたが8) 、その後も実臨床において症例数は増加を続け、2024年3月現在、30例を超えています(論文投稿準備中)。前述のUC寛解導入療法における有効性予測因子6) も参照しながら、MES 2の患者さんを中心に施行しています。
当院において、UC寛解維持療法に対し積極的にGMAを活用している背景には、併用薬剤を増やさないという安全性の視点に加え、私たちの検討においてGMAを併用することによりステロイド総投与量の低下が示され、ステロイドフリーの達成も期待される点が挙げられます9) 。これらの知見や臨床経験に基づき、GMAによるUC寛解導入から寛解維持療法は、5-ASA製剤による寛解維持療法中に再燃した、比較的発症早期あるいは再燃回数の少ない患者さんに対する選択肢の一つとして期待されます。また、近年増加している5-ASA不耐例に対する寛解維持療法としても、GMAは適しているのではないかと考えます。GMAにより寛解維持が継続した場合、分子標的薬などの治療選択肢の温存や長期的な患者QOL向上に寄与する可能性も期待しています。
IBD 診療におけるモニタリングの意義と今後の展望
現在、IBD診療において、IBD患者のQOL向上のため、目標達成に向けた治療、すなわちTreat to Target(T2T)の推進が求められます。IBDにおけるT2Tでは、モニタリングがきわめて重要となり、fCALをはじめとしてロイシンリッチα2グリコプロテイン(LRG)や尿中プロスタグランジンE主要代謝産物(PGE-MUM)などのバイオマーカーの意義は大きいと推察されます。このようなバイオマーカーを用いながら、より緻密に質の高いモニタリングを行うことで、IBD患者のQOL向上に大きく寄与するものと考えています。
1) Shimoyama, T., Yamamoto, T. et al. :Inflamm Bowel Dis. 2023;29(9):1399-1408.